Nicolas Villain est co-auteur avec le Pr Bruno Dubois des nouvelles recommandations pour le diagnostic de maladie d’Alzheimer proposées par le groupe de travail international IWG. Il a accepté de répondre à nos questions.
FCM : Encore une révision des critères de la maladie d’Alzheimer ? Était-ce nécessaire ?
NV. C’est en effet la première réflexion que je me suis faite avant de me lancer dans l’écriture de cet article en janvier 2019. Est-ce bien nécessaire de rajouter de la confusion et de donner l’impression d’entretenir une ‘guerre des critères’ avec nos collègues américains ? Puis j’ai relu, encore relu l’article de 2018 du NIA-AA(1) et plus je le lisais et plus je le confrontais avec ma pratique, plus je me disais que ce n’était pas possible de laisser dire que la maladie d’Alzheimer se définissait désormais par un statut A+T+ : qu’une simple ponction lombaire (PL) positive, quel que soit le contexte clinique (asymptomatique, autres maladie neurologique) entrainait une annonce diagnostique et une possible inclusion dans un essai thérapeutique. C’est donc ainsi, portés par la conviction qu’il y avait là un problème, qu’avec Bruno Dubois et l’International Working Group nous sommes ‘repartis au combat’.
FCM. Vos propositions sont basées sur une analyse rigoureuse de la littérature scientifique sur les biomarqueurs. Pourquoi avez-vous été convaincu, après cette large revue, que la signature biologique de la maladie d’Alzheimer reste insuffisante pour porter le diagnostic ?
NV. Premièrement les données issues des cohortes de sujets âgés cognitivement normaux montrent qu’en dépit d’un surrisque statistiquement significatif sur le groupe, nombre de ces sujets A+ ou A+T+ (même la majorité) ne développent pas de symptômes à moyen terme (5-7 ans)(2,3). De plus les meilleures modélisations statistiques actuelles estiment que selon l’âge, le sexe et la présence d’un déclin cognitif subtil seuls 5 à 44% de ces sujets développeront des symptômes de leur vivant(4). Deuxièmement la présence de lésions neuropathologiques de maladie d’Alzheimer se retrouve dans de nombreuses autres maladies neurodégénératives (au premier rang desquelles la démence à corps de Lewy)(5) pour lesquelles de tels biomarqueurs physiopathologiques viennent à manquer. Dès lors, selon la définition du NIA-AA, un patient avec une démence à corps de Lewy selon les critères de McKeith 2017(6) dont la PL reviendrait positive serait classé comme ayant une maladie d’Alzheimer et une double annonce serait à faire et une inclusion dans un protocole thérapeutique possible. Quid en plus des formes prodromales ou paucisymptomatiques de ces maladies neurodégénératives non Alzheimer où le phénotype ne se dessine pas encore clairement et où la ponction lombaire reviendrait positive ?
Une autre limite d’une définition purement biologique de la maladie d’Alzheimer est celle de la définition d’un seuil des biomarqueurs. D’un côté il y a un problème méthodologique de reproductibilité et de fiabilité des méthodes que l’on utilise actuellement avec pour exemple les difficultés d’homogénéisation de seuils entre les centres. De l’autre il y a aussi celui du seuil absolu : celui-ci n’existe tout simplement pas ! En effet les neuropathologistes ne fixent pas de seuil pathologique définissant ou non la maladie d’Alzheimer mais des degrés (faibles, modérés, élevés) de pathologie Alzheimer(7) du fait d’un chevauchement important de degré de pathologie Alzheimer entre des sujets asymptomatiques et des sujets souffrant de trouble neurocognitif majeur(8). On sait par ailleurs aujourd’hui que 100% des sujets de plus de 70 ans, quel que soit leur statut clinique, ont des dégénérescences neurofibrillaires au minimum de stade Braak I-II et 70% de ces mêmes sujets présentent également au minimum quelques dépôts amyloïdes(9). Dès lors, alors que l’amélioration grandissante de la sensibilité et de la spécificité des biomarqueurs est attendue ces prochaines années (comme le démontrent les travaux récents sur le p-Tau 217 et 231)(10,11), devrait on définir une maladie d’Alzheimer chez 70% de la population de plus de 70 ans ? Enfin, une telle définition soulève évidemment des problèmes de coût, d’accessibilité et d’éthique.
FCM : Quel a été l’objectif de cet article ?
NV. L’objectif n’est pas de se positionner sur la question philosophique de ce qu’est une maladie. Un tel débat n’apporte en effet pas de réponse claire et peut être sans cesse être remis en question. Nous nous sommes donc positionnés du point de vue du clinicien et proposons une série de 13 recommandations pragmatiques quant à l’utilisation des biomarqueurs en pratique clinique à partir des différents points soulevés par la revue de la littérature.
FCM. Revoyons ensemble vos propositions principales. Comment définissez-vous d’abord la maladie d’Alzheimer ?
NV. Nous proposons de revenir à une définition clinico-biologique de la maladie d’Alzheimer : seuls les patients avec un phénotype déjà décrit comme étant attribuable à une pathologie Alzheimer peuvent avoir un diagnostic établi de maladie d’Alzheimer. Trois phénotypes dits communs de maladie d’Alzheimer sont ainsi identifiés : l’amnésie progressive de type hippocampique, l’atrophie corticale postérieure (ACP) et la variante logopénique des aphasies progressives primaires (APP). Il s’agit de phénotypes pour lesquels les séries neuropathologiques confirment que la maladie d’Alzheimer est la pathologie sous-jacente la plus commune. Dans ces cas-là, le risque que la positivité des biomarqueurs Alzheimer témoigne d’une simple comorbidité (copathologie) d’une autre maladie neurodégénérative est considéré comme faible voire négligeable.
FCM. Quels sont selon vous les autres phénotypes compatibles avec le diagnostic de maladie d’Alzheimer ?
NV. Nous proposons que 3 autres phénotypes puissent également recevoir un diagnostic de maladie d’Alzheimer (mais seulement un diagnostic probable et non un diagnostic établi) : la variante dysexécutive/frontale, le syndrome cortico-basal (SCB) et les autres variantes d’APP (sémantique et non-fluente). En effet dans ces 3 phénotypes la pathologie Alzheimer peut être un diagnostic primaire et causal, identifié comme tel par les séries neuropathologiques, mais ce n’est pas la cause la plus commune (les protéinopathies TDP-43 ou les tauopathies non-Alzheimer dominent). Aussi, le risque que la positivité des biomarqueurs témoigne d’une simple co-pathologie est dans ces cas-là plus élevé. Enfin, le constat de biomarqueurs positifs dans un autre contexte phénotypique (démence à corps de Lewy, syndrome de Richardson, etc) doit a priori faire considérer ce résultat comme simple reflet d’une co-pathologie Alzheimer et rend improbable le diagnostic de maladie d’Alzheimer comme facteur explicatif de la symptomatologie.
FCM. La définition biologique de la maladie d’Alzheimer, on l’a compris, ne vous satisfait pas. En revanche, validez-vous la classification ATN qui a été popularisée par les critères de 2018 ?
NV. Concernant les biomarqueurs, nous reprenons en effet la classification ATN, à savoir qu’il faut la double positivité A+T+ associée à un phénotype commun pour établir un diagnostic de maladie d’Alzheimer. Toute combinaison autre de biomarqueurs (A+T-, A-T+, etc) fait baisser la probabilité du diagnostic de maladie d’Alzheimer (qui peut devenir probable, possible, improbable, exclu : cf. Table 1). Même si en France le débat n’existe du fait de l’absence de remboursement des traceurs TEP, nous recommandons qu’internationalement l’utilisation des biomarqueurs du LCR soit privilégiée car elle donne à coût moindre la double information concernant le statut amyloïde et tau. L’utilisation de biomarqueurs plasmatiques est quant à elle trop préliminaire pour être recommandée en pratique clinique. En cas de bilan neuropsychologique et/ou biomarqueurs dans la ‘zone grise’ (résultat proche du seuil), nous recommandons qu’un nouveau dosage de biomarqueurs ou que l’utilisation de biomarqueurs dégénératifs (TEP-FDG, scintigraphie de perfusion, atrophie à l’IRM, élévation de NFL dans le LCR) ou encore qu’un suivi clinique puissent être discutés afin d’affiner le diagnostic. Nous recommandons donc que le diagnostic puisse être posé sur un faisceau d’argument (clinico-biologiques mais aussi selon les cas clinico-biologico-radiologiques) et que la conclusion diagnostique soit portée par un clinicien expert.
FCM. Quid des sujets normaux ?
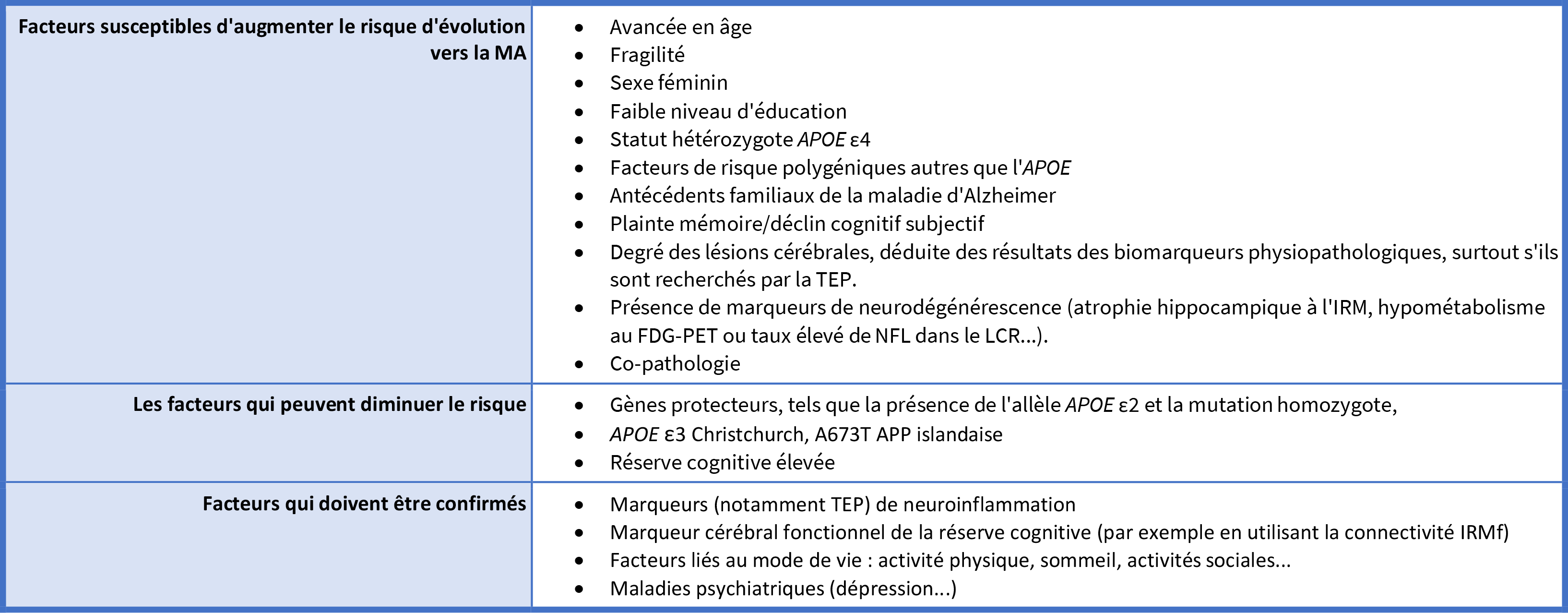
NV. Concernant les sujets cognitivement normaux, nous recommandons qu’une recherche de biomarqueurs ne soit pas réalisée. Dans les cas où il est toutefois prévu de la réaliser (souhait insistant du sujet, protocole de recherche, etc), il est recommandé de réaliser, à l’image des consultations de conseil génétique, une consultation préalable où une information sur l’intérêt et la valeur pronostique de ces biomarqueurs sera expliquée au patient. Enfin, si ces biomarqueurs reviennent positifs, nous recommandons que l’annonce faite à ces sujets asymptomatiques soit celle d’un risque de survenue de maladie d’Alzheimer et non un diagnostic de maladie d’Alzheimer. Ce risque peut-être plus ou moins élevé selon la combinaison de biomarqueurs (Table 2). Enfin, il sera important que l’amplitude de ce risque puisse être précisée par de futures recherches et que l’importance de facteurs modulant ce risque (Table 3) puisse être également précisée dans le futur.
FCM. Recommandez-vous l’utilisation systématique des biomarqueurs en soins courants ?
NV. Non. L’utilisation des biomarqueurs doit être laissée à la discrétion du clinicien selon les situations (âge du patient, comorbidités, phénotype atypique, intérêt clinique, souhait du patient de connaître le diagnostic, opportunité de participer à essai thérapeutique ‘disease modifyer’ etc). En cas de non recours aux biomarqueurs nous proposons que le terme ‘maladie neurodégénérative de type Alzheimer’ puisse être utilisé pour les patients présentant un phénotype commun de MA (amnésique, APP logopénique, ACP) et pour lesquels un biomarqueur de neurodégénérescence (atrophie à l’IRM, hypométabolisme TEP, hypoperfusion TEMP, élévation du NFL dans le LCR) a été mesuré. Dans tous les autres cas, le diagnostic devra rester purement phénotypique (ACP, APP logopénique, SCB, etc). Il faudra être alors particulièrement vigilant dans ces situations pour éliminer les étiologies non dégénératives et curables.
Références
- Jack, C. R. et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimer’s Dement. 14, 535–562 (2018).
- Dubois, B. et al. Cognitive and neuroimaging features and brain β-amyloidosis in individuals at risk of Alzheimer’s disease (INSIGHT-preAD): a longitudinal observational study. Lancet Neurol. 17, 335–346 (2018).
- Burnham, S. C. et al. Clinical and cognitive trajectories in cognitively healthy elderly individuals with suspected non-Alzheimer’s disease pathophysiology (SNAP) or Alzheimer’s disease pathology: a longitudinal study. Lancet Neurol. 15, 1044–1053 (2016).
- Brookmeyer, R. & Abdalla, N. Estimation of lifetime risks of Alzheimer’s disease dementia using biomarkers for preclinical disease. Alzheimer’s Dement. 14, 981–988 (2018).
- Robinson, J. L. et al. Neurodegenerative disease concomitant proteinopathies are prevalent, age-related and APOE4-associated. Brain 141, 2181–2193 (2018).
- McKeith, I. G. et al. Diagnosis and management of dementia with Lewy bodies. Neurology 89, 88–100 (2017).
- Hyman, B. T. et al. National Institute on Aging-Alzheimer’s Association guidelines for the neuropathologic assessment of Alzheimer’s disease. Alzheimers. Dement. 8, 1–13 (2012).
- Iacono, D. et al. Mild Cognitive Impairment and Asymptomatic Alzheimer Disease Subjects : Equivalent ABeta-Amyloid and Tau Loads With Divergent Cognitive Outcomes. J. Neuropathol. Exp. Neurol. 73, 295–304 (2014).
- Braak, H., Thal, D. R., Ghebremedhin, E. & Del Tredici, K. Stages of the pathologic process in Alzheimer disease: age categories from 1 to 100 years. J. Neuropathol. Exp. Neurol. 70, 960–969 (2011).
- Palmqvist, S. et al. Discriminative Accuracy of Plasma Phospho-tau217 for Alzheimer Disease vs Other Neurodegenerative Disorders. JAMA – J. Am. Med. Assoc. 324, 772–781 (2020).
- Ashton, N. J. et al. Plasma p-tau231: a new biomarker for incipient Alzheimer’s disease pathology. Acta Neuropathol. 141, (2021).
Table 1 : Diagnostic de la MA en clinique
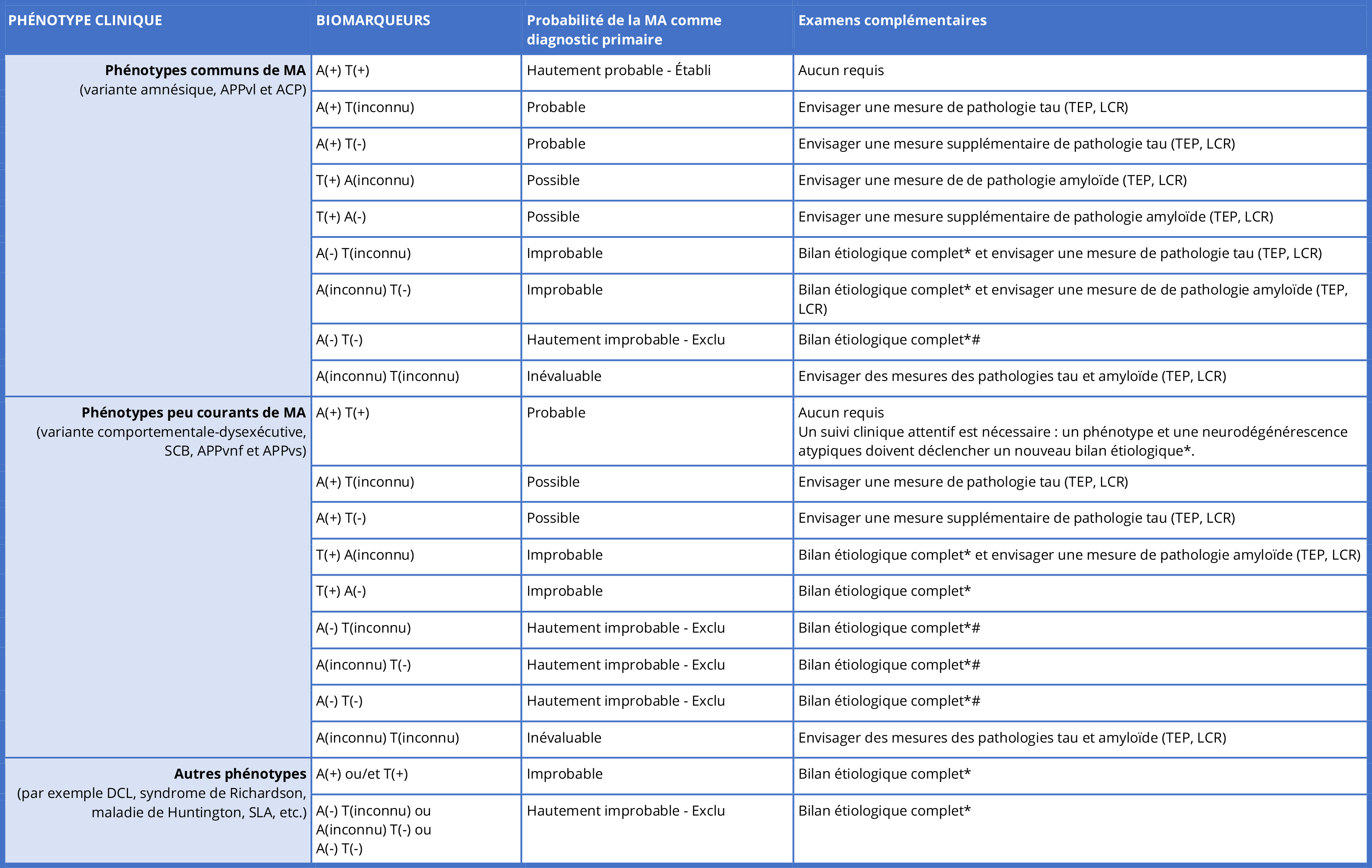
Notez que le statut de positivité des biomarqueurs doit reposer sur les normes des laboratoires locaux.
A = amyloïde ; T = tau ; MA = maladie d’Alzheimer ; APPvl = variante logopénique d’aphasie progressive primaire ; ACP = atrophie corticale postérieure ; SCB = syndrome cortico-basal ; APPvnf = variante non fluente d’aphasie primaire progressive ; APPvs = variante sémantique d’aphasie primaire progressive ; DCL = démence à corps de Lewy ; SLA = sclérose latérale amyotrophique ; TEP = tomographie par émission de positons ; LCR = liquide céphalo-rachidien.
* Le bilan étiologique complet dépend du phénotype et peut impliquer par exemple la TEP-FDG, l’imagerie dopaminergique, le dosage sérique de la progranuline, une analyse génétique, l’enregistrement des mouvements oculomoteurs, l’électromyographie, etc.
# N’envisagez une nouvelle recherche de biomarqueurs de la MA que dans les cas où vous avez un doute raisonnable quant à la validité des résultats des biomarqueurs.
Table 2 : Sujets asymptomatiques à risque de progression (ARP) : proposition de stratification du risque en fonction des résultats des biomarqueurs

* À évaluer en rapport avec les facteurs modulateurs (Table 3)
Table 3 : Vers un profil de risque personnalisé chez les sujets à risque asymptomatiques

Dr Nicolas Villain
Département de Neurologie, Institut de la Mémoire et de la Maladie d’Alzheimer, Assistance Publique - Hôpitaux de Paris, CHU Pitié-Salpêtrière, Paris, France Institut du Cerveau et de la Moelle Epinière, Paris, France

