Les points-clés
- L'essai de phase 3 testant le lecanemab, immunothérapie anti-amyloïde, est positif sur l’ensemble de ses critères de jugement principal et secondaires clefs
- Une réduction de la pente du déclin d’1/3 est observée sur les critères de jugement cliniques et fonctionnels
- Sous traitement, une négativation de la TEP amyloïde est atteinte en 18 mois chez 80% des patients et un effet en cascade est observé sur les biomarqueurs de taupathie
- L’incidence des complications oedémateurses (ARIA-E) et hémorragique (ARIA-H) reste modérée, et ces complications sont le plus souvent asymptomatiques ou réversibles
- Des démarches sont entamées auprès de la FDA et de l’agence européenne du médicament (EMA) en vue de son autorisation de mise sur le marché
Après un communiqué de presse prometteur publié le 28 septembre 2022, les résultats de l’essai de phase 3 CLARITY-AD testant le lecanemab contre placebo dans le cadre d’un essai randomisé en double aveugle et groupes parallèles de 18 mois, ont été dévoilés le 29 novembre. Beaucoup de ceux qui ont assisté à la présentation donnée au congrès CTAD ont eu l’impression de vivre un moment historique. Au même moment, pour ceux qui n’avaient pas pu faire le déplacement jusqu’à San Francisco, le New England Journal of Medicine mettait en ligne l’article de l’étude (1).
Pour ceux d’entre vous qui ont suivi, haletants parfois, frustrés souvent, la saga de l’aducanumab et ses résultats ambigus, les résultats de CLARITY-AD sont limpides en comparaison. L’étude est positive, sur son critère de jugement principal et l’ensemble de ses critères de jugement secondaires clefs. Cela ne supprime pas les interrogations, bien au contraire. Mais cette fois, le débat sur l’interprétation de données discordantes laisse la place aux questions de fond sur ces immunothérapies qui seront peut-être le quotidien de nos consultations mémoire.
Lecanemab: un rappel
Le lecanemab, ou BAN2401, est la version humanisée d’un anticorps monoclonal conçu en Suède par l’équipe de Lars Lannfeldt, au début des années 2000. Sa particularité, d’où il tient peut-être son efficacité clinique, est son affinité forte pour les oligomères et protofibrilles solubles, qui sont les plus neurotoxiques. Son affinité est 10 fois moindre pour les fibrilles insolubles des plaques amyloïdes.
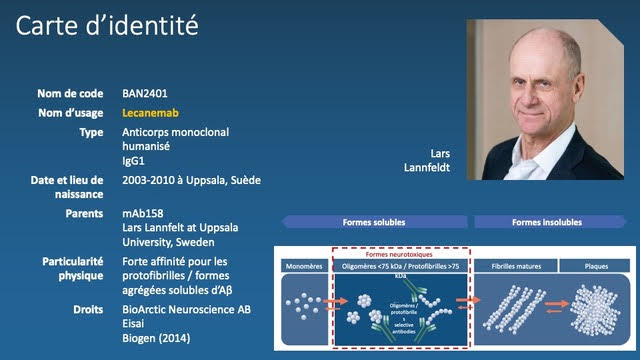
L’anticorps a rapidement fait l’objet d’un développement clinique coordonné par EISAI et BIOGEN. L’essai de phase 2b, connu sous le nom « d’étude 201 », avait, pour la première fois dans le domaine des maladies d’Alzheimer et apparentées, une méthodologie adaptative (modifications des effectifs groupes au cours de l’essai afin de rationaliser et d’optimiser le processus de sélection de la dose la plus efficace). Le critère de jugement était une échelle composite, l’ADCOMS, qui agrège 4 items de l’ADAS-Cog, 2 items du MMSE et les 6 items de la CDR (2). Publiés en 2021, les résultats montrent une diminution rapide et marquée de la charge amyloïde (>80% de TEP amyloïde négatives à 12 à 18 mois) et une réduction du déclin cognitif à 18 mois (exprimée en termes de probabilité de 76% que le déclin cognitif soit 25% inférieur à celui du groupe placebo).
Mais on ne peut parler d’immunothérapie anti-amyloïde sans évoquer leurs effets secondaires. Les médecins impliqués dans les essais d’immunothérapie se sont familiarisés avec ces complications liées à l’action de l’anticorps sur les dépôts vasculaires d’Aβ, auxquelles on a donné le nom lyrique d’ARIAs (Amyloid-related Imaging Abnormalities). Les ARIAs peuvent être oedémateux (ARIA-E), sous la forme d’un œdème vasogénique ou d’un épanchement leptoméningé sur l’IRM; ils peuvent être hémorragiques (ARIA-H), prenant l’aspect de microhémorragies, d’une sidérose superficielle ou de macro-hémorragies. La plupart sont asymptomatiques. Lorsqu’ils sont symptomatiques, les symptômes sont souvent modérés et réversibles. Mais parfois, les symptômes sont sévères et les lésions irréversibles…
Bonne nouvelle là encore, l’étude 201 montrait une faible incidence des ARIA-E totaux (<10%) et symptomatiques (<2%). Néanmoins les homozygotes pour l’allèle E4 de l’APOE, qui présentent plus volontiers une angiopathie amyloïde et des ARIAs, ont été écartés de l’étude par prudence.
Dans ces circonstances, et compte tenu des résultats encourageants de la phase 2b tant sur le plan clinique que sur celui de la sécurité d’emploi, une seule étude de phase 3 a été sollicitée par les agences en vue d’une éventuelle mise sur le marché: c’est l’étude CLARITY.
CLARITY AD : des résultats sans appel sur les critères de jugement cliniques
L’essai CLARITY-AD a inclus 1795 patients. Les critères d’inclusion étaient sensiblement les mêmes que dans l’étude 201: MA prodromale à débutante avec pathologie amyloïde prouvée par les biomarqueurs, MMSE ≥22. Deux points importants: les patients homozygotes APOE4 pouvaient désormais être inclus, de même que les patients sous anticoagulants, ce qui explique pourquoi les données de sécurité étaient particulièrement attendues.
Après randomisation, les patients ont reçu soit 10 mg/Kg de lecanemab en perfusion toutes les 2 semaines pendant 18 mois, soit le placebo, avant une phase d’extension en ouvert. L’âge médian des patients inclus était de 72 ans, le MMSE moyen à l’admission de 25,5/30;
L’étude est positive, et elle l’est sans appel. Sur le critère de jugement princial, il existe une réduction significative du déclin cognitif et fonctionnel évalué par la CDR (Clinical Dementia Rating Scale) de 27 % dans le groupe lecanemab par rapport au placebo. Le changement moyen du score CDR entre l’inclusion et le suivi à 18 mois était de 1,21 sous lecanemab et de 1,66 sous placebo (différence : −0,45 ; IC95 : −0,67 ; −0,23 ; p < 0,001). Le bénéfice s’observe dès le 6e mois et se poursuit tout au long de l’étude.
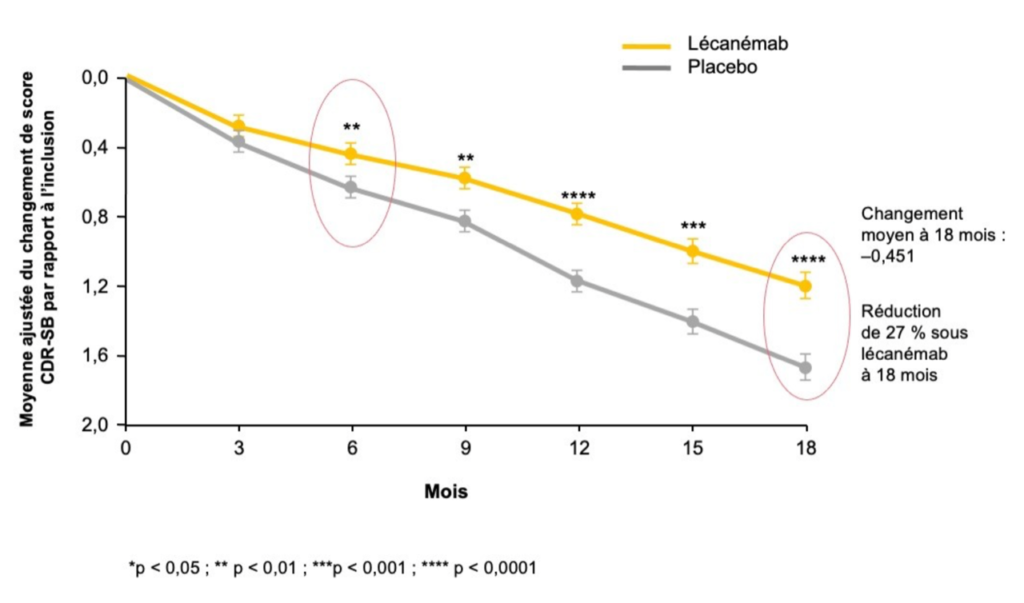
Les critères secondaires d’évaluation sont eux aussi positifs, avec une réduction significative du déclin cognitif à 18 mois évalué par le score ADAS-Cog de 26 % (p < 0,001) et par le score ADCOMS de 24 % (p < 0,001) sous lecanemab en comparaison au placebo. De même, une réduction significative du déclin fonctionnel de 37 % est retrouvée à l’échelle ADCS-MCI-ADL sous lecanemab. Ces bénéfices sur la cognition et le déclin fonctionnel apparaissent précocement (dès le 6e mois). Tous les résultats sont ajustés sur les différents facteurs confondants (âge, ApoE4, traitements anticholinestérasiques ou mémantine, région du globe, etc.) et persistent après différentes analyses de sensibilité, comme la prise en compte de la période Covid ou les arrêts de traitement pour effets indésirables.
Et il y a plus… Sur des analyses non incluses dans l’article mais présentées au CTAD, le traitement est également efficace sur les échelles de qualité de vie et de fardeau de l’aidant, qui sont pourtant difficile à faire « bouger » au stade prodromal à débutant.
Une ombre au tableau cependant, l’efficacité semble moindre chez les sujets jeunes (<65 ans) et les homozygotes APOE4, à en juger par les résultats de la CDR. Néanmoins il s’agit d’analyses de sous-groupes exploratoires qui ne permettent pas de conclure à une inefficacité du traitement sur ces populations,
Des résultats concordants sur les biomarqueurs
Il n’y avait guère de doute depuis l’étude 201 (3) que le Lecanemab savait atteindre la cible. Cela a été démontré à nouveau par une étude ancillaire de l’essai CLARITY portant sur 698 participants. La charge amyloïde chute de façon drastique chez les patients traités, dès le troisième mois, pour rejoindre des valeurs normales chez la majorité des patients à 18 mois. A l’unisson, le ratio Aβ42/40 s’élève dans le sang et le liquide cérébrospinal.
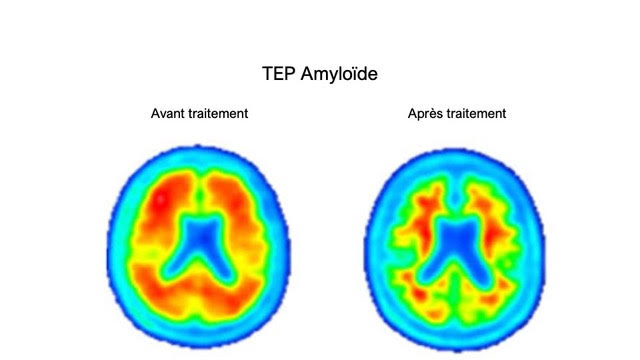
Mais le traitement a un effet bénéfique sur une pléiade de biomarqueurs dits « d’aval », à commencer par les biomarqueurs de taupathie : il existe une diminution très significative de phosho-Tau181 dans le liquide cérébrospinal et dans le plasma. Les résultats en TEP-Tau (utilisant le PI-2620, un radiotraceur spécifique des neurodégénérescences neurofibrillaires) sur 257 patients ayant participé à cette étude ancillaire sont moins démonstratifs, mais il existe néanmoins un effet significatif sur la progression du traceur dans la région temporale interne, qui semble stoppée sous traitement, suggérant que le traitement agit sur la progression de la pathologie neurofibrillaire dans cette région si critique.
Enfin comme d’autres immunothérapies anti amyloïde (4), le lecanemab majore l’atrophie cortico-sous corticale, un effet que l’on présume dû à la clairance des plaques, qui occupent de l’espace (5). Comme cela avait été esquissé avec l’aducanumab, l’atrophie hippocampique est en revanche significativement moindre chez les patients traités.
Les ARIAs sous la loupe
Les résultats étaient très attendus, CLARITY ayant inclus 15% environ de patients homozygotes E4/E4 et 4,5% de patients sous anticoagulants. Ils rassurent et invitent à l’humilité tout à la fois.
L’incidence des ARIA-E est de 12,6 % dans le groupe lecanemab (2,8 % d’ARIA-E symptomatiques) et de 1,7 % dans le groupe placebo. Les ARIA-E surviennent majoritairement lors des 3 premiers mois de traitement et sont résolutifs en 4 mois en moyenne. L’incidence des ARIA-H (macro/microhémorragie/sidérose superficielle) est de 17,3 % dans le groupe lecanemab (seulement 0,7 % d’ARIA-H symptomatiques) et de 9 % dans le groupe placebo. Le taux de macrohémorragies est de 0,6 % dans le groupe lecanemab et de 0,2 % dans le groupe placebo.
Quid des APOE4 et des sujets sous anticoagulants? Le statut APOE4 semble déterminant dans la survenue des ARIA, mais aussi dans leur caractère potentiellement symptomatique et leur sévérité radiologique. Un tiers des homozygotes et 10 % des hétérozygotes APOE4 ont développé des ARIA-E, contre 5% des non-APOE4. Pari perdu pour les anticoagulants? Le taux de macrohémorragie est plus de trois fois plus important chez les participants sous anticoagulation (2,4% des patients anticoagulés sous lecanemab).
Ainsi certes, l’incidence des ARIAs est probablement inférieure à celle observée avec l’aducanumab. Mais le lecanemab est un traitement dont la marge thérapeutique fera encore l’objet de débat, notamment chez les sujets APOE E4/E4.
Et maintenant ?
De multiples questions restent sans réponse. La principale, celle de l’index thérapeutique (rapport bénéfice/risque), a été bien argumentée par nos collègues Nicolas Villain et Vincent Planche (6).
Le bénéfice clinique modeste du lecanemab aura en effet d’autant plus de pertinence que les trajectoires cognitives et fonctionnelles des patients traités continueront à se séparer de celles des patients non traités. En d’autres termes, si le traitement est réellement disease modifyer. Les résultats en TEP tau sont un formidable argument dans ce sens, mais ces données limitées doivent être complétées par celles des suivis au long cours dans le cadre des études d’extension.
La question des effets secondaires ne doit évidemment pas être éludée, et les cliniciens seront en demande de précisions sur les réalités très diverses que recouvrent les « ARIAs symptomatiques », dont le spectre s’étend de la confusion régressive aux séquelles irréversibles fixées. Cela permettra de délivrer une information loyale aux patients en cas de mise sur le marché. Le génotypage APOE deviendra un préalable indispensable à ces discussions, et le cas des homozygotes APOE4 ou des patients sous anticoagulants suscitera probablement encore du débat.
Mais une nouvelle ère commence et chacun d’entre nous doit s’y préparer. Quelques mois ou années nous séparent peut-être de la mise sur le marché d’un nouveau traitement. Et cette opportunité bouleversera profondément les pratiques de nos centres et consultations mémoire, même éloignés de la recherche clinique, même non équipés pour l’administration d’une immunothérapie, même de petite taille. Commençons par repenser ou renforcer nos filières de diagnostic et les stratégies que nous déploierons en faveur du diagnostic précoce.
La FCM jouera à plein son rôle de fédération, de proposition et d’accompagnement dans cette période passionnante.
Pr Thibaud Lebouvier, Neurologue, CMRR de Lille
Dr Julien Delrieu, Neurogériatre, CMRR de Toulouse
Pr Olivier Hanon, Cardiogériatre, CMRR Paris Nord (Broca)
Pr Maria Soto, Gériatre, CMRR de Toulouse
Références
1. Dyck, C. H. van et al. Lecanemab in Early Alzheimer’s Disease. New Engl J Med (2022)
2. Satlin et al. Alzheimer’s & Dementia: Translational Research & Clinical Interventions (2016)
3. Swanson, C. J. et al. Alzheimer’s Res Ther 13, 80 (2021)
4. Haeberlein, S. B. et al. Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer’s Disease. J Prev Alzheimer’s Dis 1–14 (2022).
5. Fox, N. C. et al. Effects of Aβ immunization (AN1792) on MRI measures of cerebral volume in Alzheimer disease. Neurology 64, 1563–1572 (2005).
6. Villain, N., Planche, V. & Levy, R. High-clearance anti-amyloid immunotherapies in Alzheimer’s disease. Part 1: Meta-analysis and review of efficacy and safety data, and medico-economical aspects. Rev Neurol 178, 1011–1030 (2022).

Correspondances en Médecine Cognition & Vieillissement
La publication "Correspondances en Médecine Cognition & Vieillissement" a proposé plusieurs newsletters consacrées au CTAD 2022. Pour y accéder, il vous faudra créer un compte sur le site d'Edimark. Voici la procédure :
- Cliquez sur la couverture ci-jointe, vous serez redirigé vers le site web d'Edimark. Une fenêtre modale vous demandera de vous connecter ou de créer un compte
- Si vous n'avez pas de compte, créez votre compte et remplissez la partie profil
- Dès que votre compte est créé, la page devient accessible et vous êtes connectée avec votre nom de famille (en haut à droite)
- En cliquant sur votre nom, vous arrivez sur la page de votre compte où vous pouvez accéder aux newsletters via le menu de gauche. Il vous suffit ensuite de cocher Correspondances en Médecine Cognition et Vieillissement et vous recevrez les newsletters suivantes.

