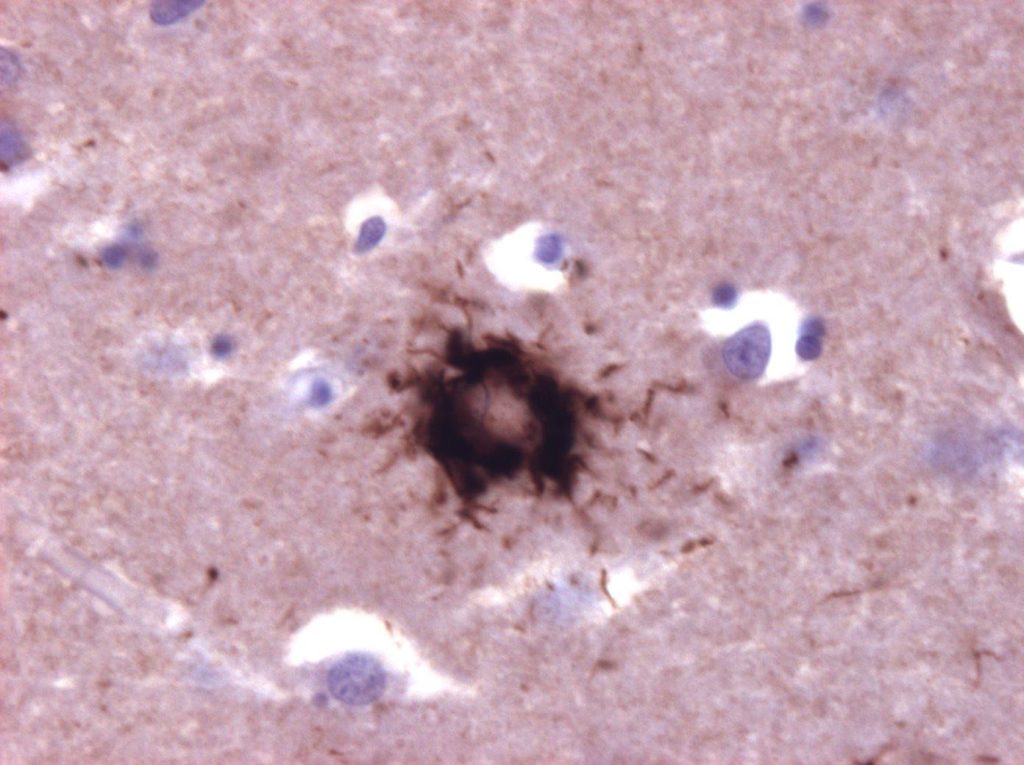
Suite et clap de fin pour l'aducanumab en Europe au moins jusqu'en 2026, l'EMA ayant annoncé que Biogen retirait sa demande d'autorisation suite au second avis négatif émis par le CHMP.
Les articles marqués d’un icône sont réservés à nos adhérents.
Vous pouvez adhérez gratuitement(1) en cliquant sur ce lien.
(1) uniquement si vous répondez aux critères d’éligibilité exigés par la Fédération des Centres Mémoire.